广西优质引流尿袋厂家
发布时间:2022-10-20 00:40:40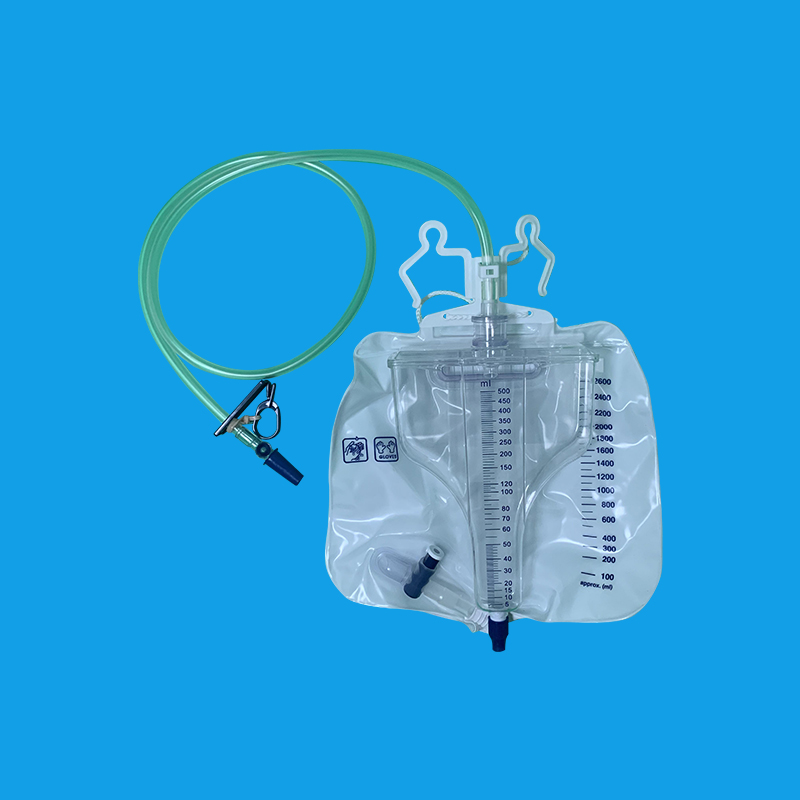
广西优质引流尿袋厂家
新华网南京5月8日电(记者刘巍巍)“‘医‘心一意 ‘器’聚高新”苏州高新区高端医疗器械产业发展大会8日举行,《苏州高新区推进高端医疗器械及生物医药产业链高质量发展三年行动计划(2021-2023年)》发布,“太湖医谷Medpark”启动建设。 《苏州高新区推进高端医疗器械及生物医药产业链高质量发展三年行动计划(2021-2023年)》确定了高端医疗器械、创新药物、前沿诊疗技术、公共卫生应急管理体系支撑产业、产业链配套支撑服务体系产业五个主攻方向。苏州高新区将每年力争新增高端医疗器械及生物医药企业超200家,2023年营收规模达到800亿元。 《行动计划》通过实施快龙头项目和企业招引、培育产业链“链主”企业、加快重点产业化项目建设投入、加速创新成果转化、提升产业链协同创新水平、持续加强金融资本支撑等“十项任务”,完成产业集聚、创新驱动提升、产业生态优化“三大工程”。 现场,苏州高新区管委会与中国医疗器械行业协会、中国生物医学工程学会、中国医学装备协会等5个战略合作机构签约,与波士顿科学、鱼跃医疗等10个产业化项目签约,与康启智能、昊本生物等10个科技创新项目签约,与云锋基金、红杉资本等10个投资机构项目签约。 同日,医疗器械产业发展中心、科技企业首贷服务中心、医疗器械合规研究中心、精准癌症分子诊断中心4个产业配套中心揭牌,中科院苏州医工所先进体外诊断技术联合创新实验室、东南大学苏州医疗器械研究院器官芯片联合创新实验室等6个实验室揭牌。 “太湖医谷Medpark”启动建设。该项目位于苏州高新区昆仑山路南、富春江路东地块,占地约156亩,规划建设瞪羚计划企业基地、独角兽培育基地、上市公司基地等三大基地,心血管器械集群、生物医用材料集群、高端医学影像集群、分子诊断集群等四个集群。 苏州高新区近年抢抓医疗器械发展风口,“十三五”期间相关产业产值年均增速超30%,集聚医疗器械领域领军人才370余人、医疗器械及生物医药企业超400家,2020年产值达200亿元。(完)

广西优质引流尿袋厂家
医学上,经由尿道插入导尿管到膀胱,引流出尿液。导尿分为导管留置性导尿及间歇性导尿二种。前者导尿管一直留置在病人体内,在病情许可应尽早拔掉管子,须定期更换。后者则每隔4-6小时导尿一次,在膀胱排空后即将导尿管拔出。 注意事项 1.应严格无菌操作,预防尿路感染。 2.插入尿管动作要轻柔,以免损伤尿道粘膜,若插入时有阻挡感可更换方向再插见有尿液流出时再插入2cm,勿过深或过浅,尤忌反复抽动尿管。 3.选择导尿管的粗细要适宜,对小儿或疑有尿道狭窄者,尿管宜细。 4.对膀胱过度充盈者,排尿宜缓慢以免骤然减压引起出血或晕厥。 5.测定残馀尿时,嘱患者先自行排尿,然后导尿。残余尿量一般为5—10ml,如超过100ml,则应留置导尿。 6.留置导尿时,应经常检查尿管情况,有否脱出,必要时以无菌药液每日冲洗膀胱一次;每隔5—7日更换尿管一次,再次插入前应让尿道松弛数小时,再重新插入。
广西优质引流尿袋厂家
注意事项 1. 严格执行无菌操作:误插阴道或脱出立即更换。 2. 控制尿潴留患者放尿速度和量:勿快,放600-800ml夹管。 3. 观察记录尿颜色、量、性质 1) 正常:1500-2000ml/24h;多尿:>2500ml/24h;少尿:<400ml/24h;无:<50ml/24h。 2) 色:正常:无色透明或淡黄色;异常:血尿、血红蛋白尿、胆红素尿、乳糜尿。 3) 妥善固定尿管,保持管道通畅,堵塞时及时检查并调整尿管位置,用呋喃西林反复冲洗必要时更换。 4) 预防泌尿系统感染不必要每天进行膀胱冲洗,需尿道口擦洗二次,病情稳定后早拔管严格执行无菌操作,每日更换尿袋,长期留管者每周更换导尿管一次,留管期间鼓励患者多饮水。 5) 预防尿道出血渗尿:插入上尿管见尿再进4-5cm后充气或注水,然后将导尿管向外轻拉至不动即可,可有效预防尿道出血或渗液。

广西优质引流尿袋厂家
尿管怎么拔出,首先应该消毒尿道口以及外露的阴茎和尿管部分,戴无菌手套,将尿管在尿道内轻轻转动,有效的减少尿管与尿道黏膜的摩擦,可以减少拔管时疼痛。然后用20mL的空针将尿管球囊内注射的液体抽出,然后用手轻轻将尿管向外牵拉,同时嘱患者行排尿动作,可以将尿管轻松拔出。拔出尿管后鼓励患者多喝水,有效的将膀胱内及尿道内沉淀物排出,减少感染的机会。

广西优质引流尿袋厂家
(三) 体系建立 1、法规背景 为加强对医疗器械的监督管理,提升企业质量管理水平,保障医疗器械产品的安全有效,根据《医疗器械监督管理条例》(国务院令650号)和《医疗器械生产监督管理办法》(国家食品药品监督管理总局令第7号),国家食品药品监督管理总局制定并印发了《关于发布医疗器械生产质量管理规范附录无菌医疗器械的公告》(2015年第101号)、《关于发布医疗器械生产质量管理规范附录植入性医疗器械的公告》(2015年第102号)及《关于发布医疗器械生产质量管理规范附录体外诊断试剂的公告》(2015年第103号)。上述三个附录是无菌医疗器械、植入性医疗器械及体外诊断试剂三类产品生产质量管理规范的特殊要求,于2015年10月1日起正式施行。 与此同时,2017年9月1日,CFDA又发布《关于一类、第二类医疗器械生产企业实施医疗器械生产质量管理规范有关工作的通知》(食药监办械监〔2017〕120号),文件强调自2018年1月1日起,所有医疗器械生产企业均应当符合《医疗器械生产质量管理规范》要求。 因此,医疗器械生产企业需严格按照法规要求建立质量管理体系。而对于初创新公司除了体系建立,还需要面临厂房选址和设计、建设等问题。 2、厂房规划 对于厂房问题,需要根据产品管理类别进行考量。非无菌产品要求相对较低。若为无菌、体外诊断类产品,则应严格按照法规和标准选址,远离有污染的空气和水(如远离铁离、码头、机场、交通要道以及散发大量粉尘、屠宰场、染料等),对厂房的设计和装修,必须请专业的团队和公司来设计和施工,如行政区、生活区和辅助区不得相互防碍影响,空气洁净级别不同的洁净室(区)之间的静压差应大于5帕,洁净室(区)与室外大气的静压差应大于10帕,空气洁净度级别进行合理布局,人流、物流走向应当合理,避免交叉污染,注意洁净室的水池或地漏等。虽然委托专业公司负责,但整个过程,都需要专业体系人员进一步把关,避免整改,比如消防、环评等通不过等。 3、人员配置 建立体系问题,初创团队到底需要多少人?哪些岗位可以兼任? 必备岗位人员:生产负责人1名、研发部负责人1名、质量负责人1名、专职检验员2名、总经理1名;可兼任岗位人员:管理者代表1名,可由质量负责人兼任;采购部负责人1名,可由研发老大兼任;销售部负责人1名,可由产品经理或总经理兼任;行政部负责人1名,也可让总经理兼任;内审员2名,持有内审资格证的即可兼任,但2人不得在同部门;生产人员1名以上; 如此算来十多个岗位,兼任下来,至少应有6人以上,《医疗器械生产质量管理规范》及相关附录中规定:“企业应当配备与生产产品相适应的专业技术人员、管理人员和操作人员,具有相应的质量检验机构或者专职检验人员的要求。要求生产负责人与质量负责人不得兼任,专职检验员也不要兼任”,虽然明确了三个岗位不得兼任,但也明确提到,应配备相适应的人员,所以还是应当根据产品配备充足的人员,避免被开出不合格项目。 4、体系认知 对于初创团队而言,我们应深知:首先,质量管理体系是个系统工作,要有系统的观念和思维。文件及记录仅仅是整个系统的一部分,一个子系统而已,此外还有关键的管理控制子系统,设计控制子系统,生产制造子系统。需要与公司的培训系统,绩效系统,营销系统等等结合互动。基于此,质量管理体系对企业来说,是企业多年运行的标准化沉淀产物。其次,符合规范要求是医疗器械企业生存的底线。行业特殊性,即法规符合性。以往,只知道要符合法规,但具体如何符合法规及指导观念往往都是比较模糊的。当前法规的目标是确保质量管理体系的有效性以持续生产安全有效的医疗器械产品。基于此,法规监管并不希望企业三天两头修改技术文件,工艺文件等,而是应保障在当前法规要求下,可持续生产安全有效医疗器械产品。若日常工作中就对法规要求有所思虑,那么质量管理体系法规符合性相对是较好的。再者,实施质量管理体系的目的,不是为了一张认证证书,而是降低风险。对企业来说,若证书拿到就万事大吉,那么企业发展必定不会长远。监管部门审核,监督,你紧张;第三方审核你也紧张;大客户来验厂,估计十之八九你还是会紧张的。与其这样,还不如老老实实的做好基础,做好系统管理。更容易达到实施体系的目的:预防为主,降低风险。后,我想说,没有继承,何来沉淀,何来文化。风来了,你是否准备好了?