新疆优质婴儿集尿袋价格
发布时间:2023-04-21 00:37:45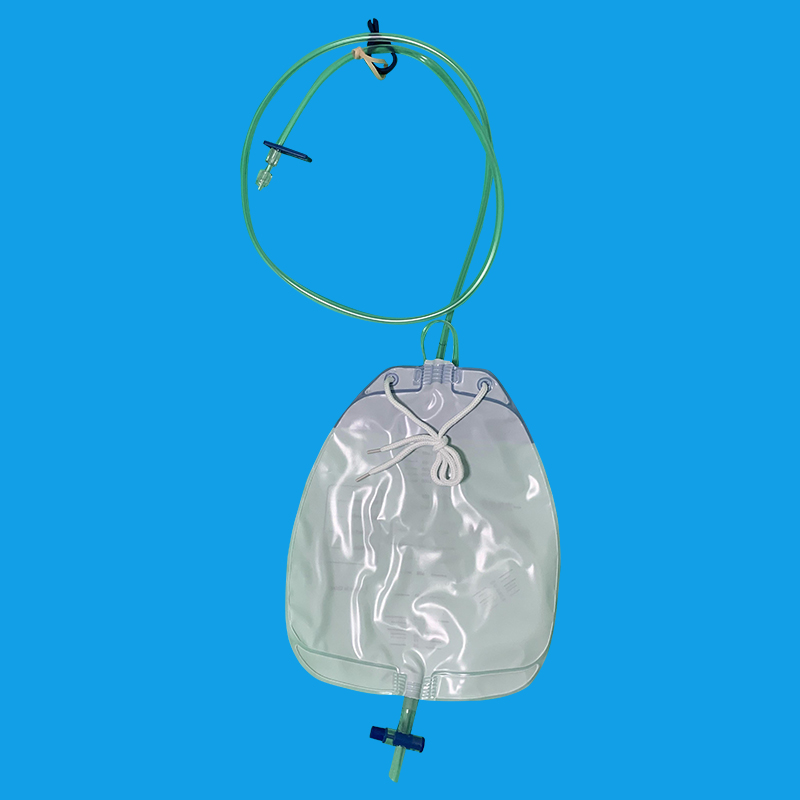
新疆优质婴儿集尿袋价格
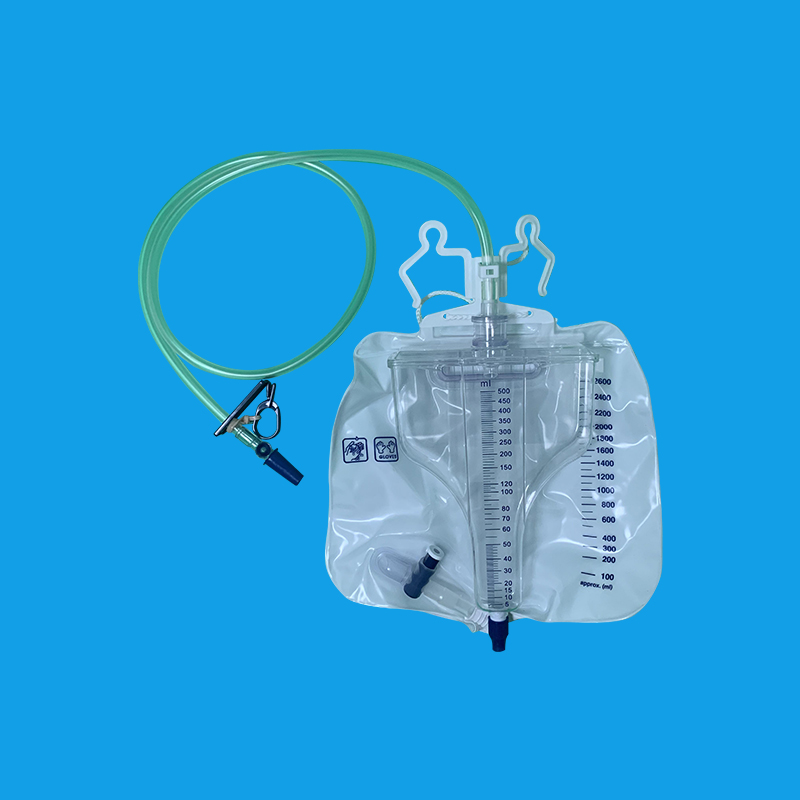
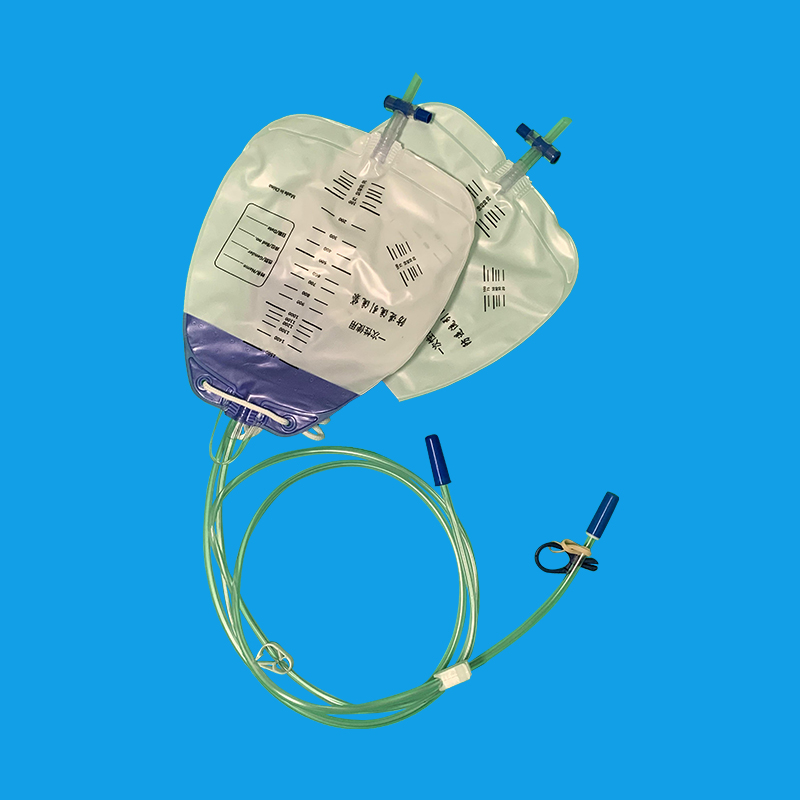
二、插管方法: 对各种原因引起排尿困难及前列腺增生患者,应充分润滑前尿道和导尿管道全长。必要时由尿管尾端开口处向导尿管注入2%的利多卡因3~4ml,再注入无菌石蜡油2~3 ml,将全长导尿管全部插入尿道并轻按膀胱区,见尿后注水充盈气囊,然后将导尿管缓缓往外牵拉至遇有阻力为止。 女病人导尿通常无困难,但有的病人找不到尿道口而导尿失败。处女膜与尿道口发生粘连变形及尿道处女膜融合症。往往尿道口显示困难,应将前庭组织往上堆,阴道前壁往外拉或于前庭正中将正常位置尿道处处女膜往下翻,将“隆起”之前庭黏膜上下左右拨弄,即可找到尿道口而顺利插入尿管。 三、插管深度: 成年男性尿道长度为17~20cm,有2个弯曲和3个狭窄部位,导尿时插入导管20~22cm,见尿液流出后再插入2cm;成年女性尿道为3~5 cm,富于扩张性,导尿时需轻轻插入尿道4~6cm,见尿液后再插入1cm。人在不同生理状态下,尿道长度也会发生改变,孕妇由于体内激素的作用及增大的子宫压迫下腔静脉,使盆底组织疏松,充血水肿,尿道相对延长。为降低剖宫产孕妇留置尿管的重插率,对尿管插入长度进行了研究,认为尿道插入为8~10cm时,重插率明显低于传统方法。 四、气囊注水量: 根据正常人尿道的直径女性注水15~20ml,成年男性10~~15ml,注入过少使球囊部不能充分与尿道口相嵌,易导致尿道外口溢尿或尿管脱出。
新疆优质婴儿集尿袋价格
尿管怎么拔出,首先应该消毒尿道口以及外露的阴茎和尿管部分,戴无菌手套,将尿管在尿道内轻轻转动,有效的减少尿管与尿道黏膜的摩擦,可以减少拔管时疼痛。然后用20mL的空针将尿管球囊内注射的液体抽出,然后用手轻轻将尿管向外牵拉,同时嘱患者行排尿动作,可以将尿管轻松拔出。拔出尿管后鼓励患者多喝水,有效的将膀胱内及尿道内沉淀物排出,减少感染的机会。

新疆优质婴儿集尿袋价格
在药品领域,全国性集采已经常态化,在药品领域,当年的“神药”和“仿制药大户”已经逐渐在向创新药企的转型。 2011年,南都搞了一个大新闻:广州一名冠心病患者做了三起心脏介入手术,总共17.5万元,其中器械材料费高达15万多。 相比于药品在我国博大精深的历史,大众对医疗器械这个名词认知度不是很高,但它和药品一样不可或缺,电视剧中,对骨折病人处理用的一条白布绑两根棍子,算得上是基础的医疗器械。 因为认知度不高,大众往往对以药养医很熟悉,对器械贵没什么概念,但在世纪初医改尚未启航、医疗体系尚不健全的年代,器械要价之高,相比于药品有过之而无不及。 2000年我国心脏介入手术的数量是2万例,到2011年达到了40.8万例,增长了二十多倍。对冠心病患者来说,国际上放支架和做搭桥手术的比例是7:1,在中国则高达12:1。这多出来的几成,在我国1.2亿心血管患者和两万一个支架的背景下,足够养活几百家医疗器械流通商。 2009年全民医保落地以来,顶层上下都在探讨打击医疗器械高价格的政策,但药品有一定工业积累,市场竞争足够充分,顶层尚可利用行政力量去博弈。而大部分器械及耗材都面临这国外企业的技术垄断和专利控制,无论是监管层还是下游采购,基本没有选择权。 2013年,知名美国药企强生在国内输了一场特殊的官司:强生因为在手术用缝线的垄断地位,去干预经销商的低转售价格,后被法院叫停。基层市场偏远,大药企放不下身段就都交给经销商,而这种“我不准你低价甩卖”的强盗逻辑从侧面反应出一个事实:这些救命用的产品仍然是一个卖方市场。

新疆优质婴儿集尿袋价格
二、明确要求建立鼓励创新医疗器械机制 新《条例》修订的核心内容之一是实行医疗器械注册人、备案人制度。实行医疗器械注册人、备案人制度,有利于鼓励产品创新、优化资源配置、落实主体责任、推动管理创新。 首先,新《条例》提出,“对创新医疗器械予以优先审评审批”,这就要求药品监管部门要建立健全创新医疗器械审评审批机制,强化审评员队伍建设,进一步优化审评流程,提高审评效率。 其次,新《条例》新增了未在境外上市的创新医疗器械,可以不提交(备案人)注册申请人所在国(地区)主管部门准许该医疗器械上市销售的证明文件。这将鼓励国际创新医疗器械首先在我国申报上市。 后,新《条例》新增对用于治疗罕见疾病、严重危及生命且尚无有效治疗手段的疾病和应对公共卫生事件等急需的医疗器械,可以作出附条件批准决定。明确了鼓励创新的方向,有利于加快创新产品上市。 广东省药品监管部门将以新《条例》颁布实施为契机,全面总结医疗器械注册人制度试点工作,坚持以创新发展为导向,坚持创新服务发展,助推创新产品上市,助力产业创新发展。研究出台深化医疗器械审批制度改革的政策举措,进一步优化审评审批流程,完善制度建设,提高审评审批效能。加强信息化建设,逐步将注册管理、生产许可、监督检查、监督抽检等信息有机整合,实现全省系统信息共享。加快推进医疗器械标识实施,深化卫健、医保、药监三医联动机制,全面推进药品监管体系和监管能力现代化综合改革。
新疆优质婴儿集尿袋价格
医疗器械是与人类生命健康息息相关的产品,世界各国对医疗器械行业的发展高度重视。近年来随着我国经济发展“供给侧结构性改革”战略的实施,将医疗器械产业的发展列入了国家发展战略中,医疗器械行业进入高速发展期,逐渐跻身国际医疗器械行业,从消费大国逐渐转化为制造大国和出口大国。 随着全球公众健康意识增强,医疗服务机构对高品质医疗器械的要求不断提高,各国政府为提升医疗器械的安全性制定了相应的法律法规,以保护民众的生命安全。 因此我国医疗器械行业在走出国门时有必要对相关国家的法律法规有所了解,并知晓相应的监管要求和市场需求的方向,针对性地采取相应的策略和措施,稳步推进,不断提高产品的能级,逐步扩大海外市场。本期小编整理了中国主要出口国家和地区医疗器械的准入要求,供大家参考。 1、医疗器械定义 医疗器械是指直接或者间接用于人体的仪器、设备、器具、体外诊断试剂及校准物、材料以及其他类似或者相关的物品,包括所需要的计算机软件。 2.常见医疗器械产品海关税则号与名称 3、主要国家和地区分类及要求 美国FDA 美国食品药品监督管理局(简称:FDA),其职责是确保美国本国生产或进口的食品、化妆品、药物、生物制剂、医疗设备和放射产品等的安全,同时也负责执行公共卫生条件及州际旅行和运输的检查、对于诸多产品中可能存在的疾病的控制等。 分类 医疗器械范围很广,小到医用手套,大至心脏起博器,均在FDA监督之下,根据医疗用途和对人体可能的伤害,FDA将医疗器械分为Ⅰ、Ⅱ、Ⅲ类,等级越高监督越严。 一类(低至中度风险):普通管理。是指风险小或无风险的产品。 第二类(中度至高度风险):普通+特殊管理。其管理是在“普通管理”的基础上,还要通过实施标准管理或特殊管理,以保证质量和安全有效性。 第三类(高风险):上市前批准管理(PMA)。是指具有较高风险或危害性,或是支持或维护生命的产品,例如人工心脏瓣膜、心脏起搏器、人工晶体、人工血管等。 准入要求 对Ⅰ类产品,企业向FDA递交相关资料并审核通过后,FDA只进行公告,但并无相关证件发给企业; 对Ⅱ、Ⅲ类器械,企业须递交PMN或PMA,FDA在公告的同时,会给企业以正式的市场准入批准函件(Clearance),即允许企业以自己的名义在美国医疗器械市场上直接销售其产品。至于申请过程中是否到企业进行现场GMP考核,则由FDA根据产品风险等级、管理要求和市场反馈等综合因素决定。